Contents
【問題】
【難易度】★★★☆☆(普通)
次の文章は,自動車用バッテリーなどに用いられている鉛蓄電池に関する記述である。文中の\( \ \fbox{$\hskip3em\Rule{0pt}{0.8em}{0em}$} \ \)に当てはまる最も適切なものを解答群の中から選べ。
鉛蓄電池は正極活物質に二酸化鉛,負極活物質に鉛,電解質に硫酸水溶液を用い,電極反応は以下の式で表される。
(正極)\(\mathrm {PbO_{2} \ + \ 3H^{+} \ + \ {HSO_{4}}^{-} \ + \ 2e^{-} ⇄ \fbox { (1) } \ + \ 2H_{2}O} \)
(負極)\(\mathrm {Pb \ + \ {HSO_{4}}^{-} ⇄ \fbox { (1) } \ + \ H^{+} \ + \ 2e^{-}} \)
電解質の濃度は満充電時に約\( \ 30 \ % \ \)である。放電するのに伴って濃度は\( \ \fbox { (2) } \ \)。正極活物質の鉛の価数は\( \ \fbox { (3) } \ \)である。電気量\( \ 200 \ \mathrm {A\cdot h} \ \)の放電で反応する正極活物質の量は\( \ \fbox { (4) } \ \)の法則から\( \ \fbox { (5) } \ \mathrm {g} \ \)である。なお,二酸化鉛のモル質量を\( \ 239.2 \ \mathrm {g/mol} \ \),電気素量を\( \ 1.602\times 10^{-19} \ \mathrm {C} \ \),アボガドロ定数を\( \ 6.022\times 10^{23} \ \mathrm {mol}^{-1} \ \)とする。
〔問4の解答群〕
\[
\begin{eqnarray}
&(イ)& \mathrm {Pb_{2}SO_{4}} &(ロ)& 2 &(ハ)& 0 \\[ 5pt ]
&(ニ)& フレミング &(ホ)& 変わらない &(ヘ)& 1785 \\[ 5pt ]
&(ト)& 質量作用 &(チ)& 4 &(リ)& 892.6 \\[ 5pt ]
&(ヌ)& 低くなる &(ル)& \mathrm {PbSO_{3}} &(ヲ)& 高くなる \\[ 5pt ]
&(ワ)& 446.3 &(カ)& \mathrm {PbSO_{4}} &(ヨ)& ファラデー \\[ 5pt ]
\end{eqnarray}
\]
【ワンポイント解説】
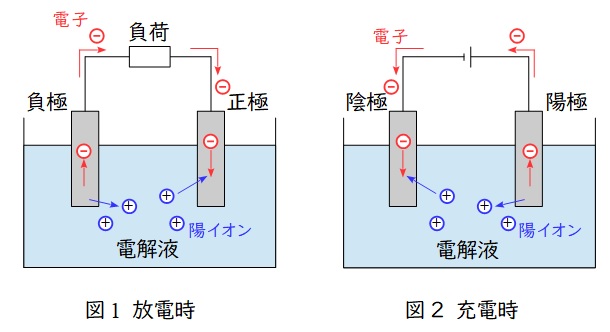
鉛蓄電池は蓄電池の一つで,問題文にあるように自動車のバッテリーや発電所の非常用電源として使用されます。1個あたりの電圧は\( \ 2 \ \mathrm {V} \ \)となります。
1.鉛蓄電池
代表的な二次電池(蓄電池)の一つで,正極と負極では以下のような反応となります。
正極では鉛原子の価数が\( \ 4 \ \)の\( \ \mathrm {PbO_{2}} \ \)から価数が\( \ 2 \ \)の\( \ \mathrm {PbSO_{4}} \ \)に変わる還元反応,負極では鉛原子の価数が\( \ 0 \ \)の\( \ \mathrm {Pb} \ \)から価数が\( \ 2 \ \)の\( \ \mathrm {PbSO_{4}} \ \)に変わる酸化反応となります。
①反応式(放電時,充電時は逆)
\[
\begin{eqnarray}
正極&:& \mathrm {PbO_{2}} &+& \mathrm {{SO_{4}}^{2-}} &+& \mathrm {4H^{+}} + \mathrm {2e^{-}} &→& \mathrm {PbSO_{4}} &+& \mathrm {2H_{2}O } \\[ 5pt ]
負極&:& \mathrm {Pb} &+& \mathrm {{SO_{4}}^{2-}} && &→& \mathrm { PbSO_{4}} &+& \mathrm {2e^{-} } \\[ 5pt ]
\hline
全体&:& \mathrm {Pb} &+& \mathrm {PbO_{2}} &+& \mathrm {2H_{2}SO_{4}} &→& \mathrm {2PbSO_{4}} &+& \mathrm {2H_{2}O } \\[ 5pt ]
\end{eqnarray}
\]
【解答】
(1)解答:カ
題意より,解答候補は(イ)\( \ \mathrm {Pb_{2}SO_{4}} \ \),(ル)\( \ \mathrm {PbSO_{3}} \ \),(カ)\( \ \mathrm {PbSO_{4}} \ \),となると思います。ワンポイント解説「1.鉛蓄電池」の通り,放電時生成されるのはどちらも\( \ \mathrm {PbSO_{4}} \ \)となります。
(2)解答:ヌ
題意より,解答候補は(ホ)変わらない,(ヌ)低くなる,(ヲ)高くなる,となると思います。ワンポイント解説「1.鉛蓄電池」の全体の反応式通り,電解質である\( \ \mathrm {H_{2}SO_{4}} \ \)は放電時使用されるため,濃度は低くなります。
(3)解答:チ
題意より,解答候補は(ロ)\( \ 2 \ \),(ハ)\( \ 0 \ \),(チ)\( \ 4 \ \),となると思います。ワンポイント解説「1.鉛蓄電池」の通り,正極活物質である\( \ \mathrm {PbO_{2}} \ \)の価数\( \ 4 \ \)となります。
(4)解答:ヨ
題意より,解答候補は(ニ)フレミング,(ト)質量作用,(ヨ)ファラデー,となると思います。ファラデーの法則は電極に析出する物質の質量に関する法則で,電気分解に関する基本的な法則となります。
(5)解答:リ
電気量\( \ 200 \ \mathrm {A\cdot h} \ \)の放電で反応する電荷は,
\[
\begin{eqnarray}
200\times 3600 &=&720000 \ \mathrm {[C]} \\[ 5pt ]
\end{eqnarray}
\]
であるので,反応する電子の物質量は,
\[
\begin{eqnarray}
\frac {720000}{1.602\times 10^{-19}\times 6.022\times 10^{23}} &≒&7.463 \ \mathrm {[mol]} \\[ 5pt ]
\end{eqnarray}
\]
となる。正極では,二酸化鉛\( \ 1 \ \)に対し電子が\( \ 2 \ \)反応するので,二酸化鉛の物質量は,
\[
\begin{eqnarray}
\frac {7.463}{2} &≒&3.732 \ \mathrm {[mol]} \\[ 5pt ]
\end{eqnarray}
\]
となる。二酸化鉛のモル質量が\( \ 239.2 \ \mathrm {g/mol} \ \)であるので,反応する二酸化鉛の量は,
\[
\begin{eqnarray}
3.732\times 239.2 &≒&892.7 \ \mathrm {[g]} \\[ 5pt ]
\end{eqnarray}
\]
となり,最も近いのは(リ)\( \ 892.6 \ \)となる。












 【令和8年度版2種一次試験】
【令和8年度版2種一次試験】








 愛知県出身 愛称たけちゃん
詳しくは
愛知県出身 愛称たけちゃん
詳しくは