Contents
【問題】
【難易度】★★★☆☆(普通)
次の文章は,電気化学システムに関する記述である。文中の\( \ \fbox{$\hskip3em\Rule{0pt}{0.8em}{0em}$} \ \)に当てはまる最も適切なものを解答群の中から選べ。
電気エネルギーと化学エネルギーを直接変換する電気化学システムは,基本構成として,電子伝導体である二つの電極とイオン伝導体である\( \ \fbox { (1) } \ \)とから構成されている。二つの電極はそれぞれアノード及びカソードと呼ばれ,各々役目が異なる。アノードでは\( \ \fbox { (2) } \ \)反応が起こる。電池反応においてはそれぞれの電極上の活物質である,酸化剤と還元剤の反応エネルギーが電気エネルギーとして外部に取り出される。このとき,外部に取り出された電気量は,消費した酸化剤及び還元剤の物質量に比例する。これを\( \ \fbox { (3) } \ \)の法則という。電池の放電において,酸化剤は\( \ \fbox { (4) } \ \)極活物質であり,鉛蓄電池ではこの酸化剤として\( \ \fbox { (5) } \ \)が利用されている。
〔問5の解答群〕
\[
\begin{eqnarray}
&(イ)& 参照 &(ロ)& 負 &(ハ)& 正 \\[ 5pt ]
&(ニ)& 二酸化鉛 &(ホ)& 硫酸鉛 &(ヘ)& 鉛 \\[ 5pt ]
&(ト)& 電解質 &(チ)& セパレータ &(リ)& 還元 \\[ 5pt ]
&(ヌ)& 酸化 &(ル)& アノライト &(ヲ)& 中和 \\[ 5pt ]
&(ワ)& オーム &(カ)& ファラデー &(ヨ)& マクスウェル \\[ 5pt ]
\end{eqnarray}
\]
【ワンポイント解説】
電気化学システムの概要と鉛蓄電池の反応に関する問題です。
高校化学でしっかりと学習されている方であれば問題なく解ける内容ですが,電験のテキストですと解説が少ない内容です。
特に(4)と(5)はここでしっかりと理解しておきましょう。
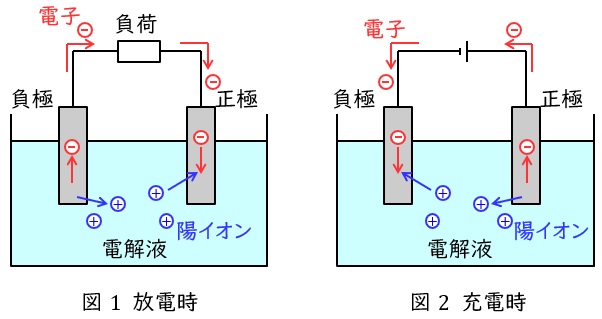
1.鉛蓄電池
電解質に希硫酸,正極に二酸化鉛\( \ \left( \mathrm {PbO_{2}}\right) \ \),負極に鉛\( \ \left( \mathrm {Pb}\right) \ \)を用いた電池で,代表的な二次電池(蓄電池)の一つです。正極と負極では以下のような反応となります。
放電時は,正極では鉛原子の価数が\( \ 4 \ \)の二酸化鉛\( \ \left( \mathrm {PbO_{2}}\right) \ \)から価数が\( \ 2 \ \)の硫酸鉛\( \ \left( \mathrm {PbSO_{4}}\right) \ \)に変わり電子を受け取る還元反応,負極では鉛原子の価数が\( \ 0 \ \)の鉛\( \ \left( \mathrm {Pb}\right) \ \)から価数が\( \ 2 \ \)の硫酸鉛\( \ \left( \mathrm {PbSO_{4}}\right) \ \)に変わり電子を放出する酸化反応となります。充電時は逆に正極が電子を放出する酸化反応,負極が電子を受け取る酸化反応となります。
【反応式】
\[
\begin{eqnarray}
正極&:& \mathrm {PbO_{2}} &+& \mathrm {3H^{+}} + \mathrm {{HSO_{4}}^{-}} + \mathrm {2e^{-}} &\array { 放電 \\ ⇄ \\ 充電 }& \mathrm {PbSO_{4}} &+& \mathrm {2H_{2}O } \\[ 5pt ]
負極&:& \mathrm {Pb} &+& \mathrm {{HSO_{4}}^{-}} &\array { 放電 \\ ⇄ \\ 充電 }& \mathrm { PbSO_{4}} &+& \mathrm {H^{+}} + \mathrm {2e^{-} } \\[ 5pt ]
\hline
全体&:& \mathrm {Pb} &+& \mathrm {PbO_{2}} + \mathrm {2H_{2}SO_{4}} &\array { 放電 \\ ⇄ \\ 充電 }& \mathrm {2PbSO_{4}} &+& \mathrm {2H_{2}O } \\[ 5pt ]
\end{eqnarray}
\]
2.電気分解におけるファラデーの法則
電極に析出する物質の質量\( \ W \ \mathrm {[g]} \ \)は溶液を通過する電気量\( \ Q \ \mathrm {[C]} \ \)に比例する(第\( \ 1 \ \)法則)もしくは物質の化学当量(=原子量\( \ m \ \)/原子価\( \ n \ \))に比例する(第\( \ 2 \ \)法則)という法則で,ファラデー定数を\( \ F≒96 \ 500 \ \mathrm {[C / mol]} \ \)とすると,
\[
\begin{eqnarray}
W&=&\frac {1}{F}\cdot \frac {m}{n} Q \\[ 5pt ]
\end{eqnarray}
\]
となります。また,電流\( \ I \ \mathrm {[A]} \ \)を時間\( \ t \ \mathrm {[s]} \ \)通電していたとすると,\( \ Q=It \ \)の関係から,
\[
\begin{eqnarray}
W&=&\frac {1}{F}\cdot \frac {m}{n} It \\[ 5pt ]
\end{eqnarray}
\]
となります。
※ファラデーの法則を覚えても良いですが,できるだけ単位や化学式を用いた解法をマスターするようにしましょう。
【解答】
(1)解答:ト
題意より解答候補は,(ト)電解質,(チ)セパレータ,(ル)アノライト,等になると思います。
ワンポイント解説「1.鉛蓄電池」の通り,鉛蓄電池でいう希硫酸等のイオン伝導体は電解質と呼ばれます。アノライトはアノードと同じ意味です。
(2)解答:ヌ
題意より解答候補は,(リ)還元,(ヌ)酸化,(ヲ)中和,になると思います。
電気化学システムにおいて,アノードでは酸化反応が起こり,カソードでは還元反応が起こります。
(3)解答:カ
題意より解答候補は,(ワ)オーム,(カ)ファラデー,(ヨ)マクスウェル,になると思います。
ワンポイント解説「2.電気分解におけるファラデーの法則」の通り,外部に取り出された電気量が,消費した酸化剤及び還元剤の物質量に比例する法則をファラデーの法則といいます。
(4)解答:ハ
題意より解答候補は,(ロ)負,(ハ)正,になると思います。
酸化剤は正極側で電子を受け取って還元される物質で正極活物質といいます。
(5)解答:ニ
題意より解答候補は,(ニ)二酸化鉛,(ホ)硫酸鉛,(ヘ)鉛,になると思います。
ワンポイント解説「1.鉛蓄電池」の通り,鉛蓄電池ではこの酸化剤として二酸化鉛が利用されています。












 【令和8年度版2種一次試験】
【令和8年度版2種一次試験】








 愛知県出身 愛称たけちゃん
詳しくは
愛知県出身 愛称たけちゃん
詳しくは