Contents
【問題】
【難易度】★★★☆☆(普通)
次の文章は,アルカリマンガン乾電池に関する記述である。文中の\( \ \fbox{$\hskip3em\Rule{0pt}{0.8em}{0em}$} \ \)に当てはまる最も適切なものを解答群の中から選べ。
アルカリマンガン乾電池は負極に亜鉛粉,正極に\( \ \fbox { (1) } \ \),電解液に\( \ \fbox { (2) } \ \)水溶液を用いた公称電圧\( \ 1.5 \ \mathrm {V} \ \)の一次電池である。あるアルカリマンガン乾電池を\( \ 1000 \ \mathrm {mA} \ \)の定電流でセル電圧が所定の終止電圧になるまで放電したとき,通電電気量が\( \ 6000 \ \mathrm {mA\cdot h} \ \),電力量が\( \ 6.60 \ \mathrm {W\cdot h} \ \)であった。このとき,放電に要した時間は\( \ \fbox { (3) } \ \mathrm {h} \ \),平均電圧は\( \ \fbox { (4) } \ \mathrm {V} \ \)となる。放電で水酸化亜鉛(\( \ \mathrm {Zn(OH)_{2}} \ \))のみが生成されるとすると,その質量は\( \ \fbox { (5) } \ \mathrm {g} \ \)である。ただし,亜鉛,酸素及び水素の原子量をそれぞれ\( \ 65.38 \ \),\( \ 16.00 \ \)及び\( \ 1.01 \ \),ファラデー定数を\( \ 26.80 \ \mathrm {A\cdot h/mol} \ \)とする。
〔問6の解答群〕
\[
\begin{eqnarray}
&(イ)& 二酸化マンガン &(ロ)& 22.2 &(ハ)& 1.2 \\[ 5pt ]
&(ニ)& 塩化アンモニウム &(ホ)& 1.1 &(ヘ)& 6 \\[ 5pt ]
&(ト)& 11.1 &(チ)& 8 &(リ)& マンガン \\[ 5pt ]
&(ヌ)& 硫酸 &(ル)& 4 &(ヲ)& 水酸化カリウム \\[ 5pt ]
&(ワ)& 1.5 &(カ)& 5.55 &(ヨ)& マンガン錯体 \\[ 5pt ]
\end{eqnarray}
\]
【ワンポイント解説】
通称アルカリ乾電池と呼ばれている電池からの出題です。もう少しメジャーな内容を出題してくれると嬉しいのですが,若干マイナーな分野からの出題となります。(3)~(5)は高校レベルの化学の知識があり計算力があれば,初見でも解ける問題となりますので,日頃から計算力を身に着けるようにしましょう。
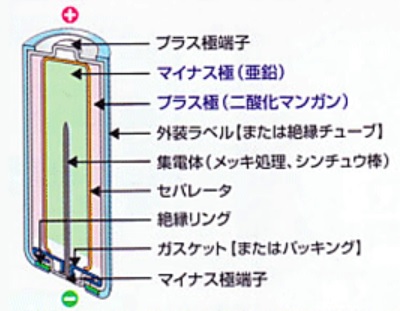
1.アルカリ乾電池
正極と負極の材料はマンガン乾電池と同じものですが,電解液をアルカリ性である水酸化カリウム水溶液を使用するため,アルカリマンガン乾電池と呼ばれます。
正極:二酸化マンガン
負極:亜鉛
電解液:水酸化カリウム水溶液
出典:一般社団法人 電池工業会 HP
https://www.baj.or.jp/battery/qa/battery.html
【解答】
(1)解答:イ
題意より,解答候補は(イ)二酸化マンガン,(リ)マンガン,(ヨ)マンガン錯体,になると思います。ワンポイント解説「1.アルカリ乾電池」の通り,アルカリマンガン乾電池では正極に二酸化マンガンを使用します。
(2)解答:ヲ
題意より,解答候補は(ニ)塩化アンモニウム,(ヌ)硫酸,(ヲ)水酸化カリウム,になると思います。ワンポイント解説「1.アルカリ乾電池」の通り,アルカリマンガン乾電池では電解液に水酸化カリウム水溶液を使用します。
(3)解答:ヘ
本問において,\( \ 1000 \ \mathrm {mA} \ \)の定電流でセル電圧が所定の終止電圧になるまで放電したとき,通電電気量が\( \ 6000 \ \mathrm {mA\cdot h} \ \)であるから,放電に要した時間は,
\[
\begin{eqnarray}
\frac {6000}{1000}&=&6 \ \mathrm {[h]} \\[ 5pt ]
\end{eqnarray}
\]
と求められる。
(4)解答:ホ
本問において,通電電気量が\( \ 6000 \ \mathrm {mA\cdot h} \ \),電力量が\( \ 6.60 \ \mathrm {W\cdot h} \ \)であるから,平均電圧は,
\[
\begin{eqnarray}
\frac {6.6}{6000\times 10^{-3}}&=&1.1 \ \mathrm {[V]} \\[ 5pt ]
\end{eqnarray}
\]
と求められる。
(5)解答:ト
亜鉛\( \ \mathrm {Zn} \ \)は\( \ 1 \ \)原子あたり\( \ 2 \ \)価の陽イオンとなるから,負極では\( \ 2 \ \)個の電子を放出し,電解質中の水酸化物イオンと反応して,水酸化亜鉛(\( \ \mathrm {Zn(OH)_{2}} \ \))が生成する。(実際にはもっと複雑な反応です。)
通電電気量が\( \ 6000 \ \mathrm {mA\cdot h} \ \)でファラデー定数が\( \ 26.80 \ \mathrm {A\cdot h/mol} \ \)であるから,亜鉛の物質量\(N \ \mathrm {[mol]}\)は,
\[
\begin{eqnarray}
N&=&\frac {6000\times 10^{-3}}{26.8}\times \frac {1}{2} \\[ 5pt ]
&≒&0.11194 \ \mathrm {[mol]} \\[ 5pt ]
\end{eqnarray}
\]
となるので,生成される水酸化亜鉛(\( \ \mathrm {Zn(OH)_{2}} \ \))は,水酸化亜鉛の\( \ 1 \ \)モル当たりの質量\( \ M \ \)が,
\[
\begin{eqnarray}
M&=&65.38\times 1 +16.00\times 2 +1.01\times 2 \\[ 5pt ]
&=&99.4 \ \mathrm {[g/mol]} \\[ 5pt ]
\end{eqnarray}
\]
であるから,
\[
\begin{eqnarray}
N\times M&=&0.11194\times 99.4 \\[ 5pt ]
&≒&11.1 \ \mathrm {[g]} \\[ 5pt ]
\end{eqnarray}
\]
と求められる。












 【令和8年度版2種一次試験】
【令和8年度版2種一次試験】








 愛知県出身 愛称たけちゃん
詳しくは
愛知県出身 愛称たけちゃん
詳しくは