【問題】
【難易度】★★☆☆☆(やや易しい)
次の文章は,燃料電池に関する記述である。文中の\( \ \fbox{$\hskip3em\Rule{0pt}{0.8em}{0em}$} \ \)に当てはまる最も適切なものを解答群の中から選びなさい。
水素エネルギーはクリーンなエネルギーとして期待されている。この水素エネルギーを有効に利用できるものが燃料電池である。燃料電池では水素を燃料とし,酸化剤としては空気中の酸素とするものが最も多い。ここでは電気化学システムが用いられ,これは\( \ 2 \ \)本の電極と,その間に介在する\( \ \fbox { (1) } \ \)伝導体である電解質とから成り立っている。\( \ 2 \ \)本の電極のうち水素は\( \ \fbox { (2) } \ \)に供給され,ここでは酸化反応が起こる。
ここで得られる理論電圧はこの反応のギブズエネルギー変化によって決まる。水素と酸素から水ができる反応は発熱反応であり,高温では理論電圧は\( \ \fbox { (3) } \ \)なる。また,得られる理論的な電気量はファラデーの法則から決まるが,具体的には消費する気体の\( \ \fbox { (4) } \ \)に比例する。また,電気化学反応に関与する電子数も重要な要素であるが,水素\( \ 1 \ \)分子では\( \ 2 \ \)電子,酸素\( \ 1 \ \)分子では\( \ \fbox { (5) } \ \)電子が関与する反応である。
〔問4の解答群〕
\[
\begin{eqnarray}
&(イ)& 2 &(ロ)& 低 く &(ハ)& 変化しなく \\[ 5pt ]
&(ニ)& 1 &(ホ)& 4 &(ヘ)& 酸化還元電位 \\[ 5pt ]
&(ト)& イオン &(チ)& 高 く &(リ)& アノード \\[ 5pt ]
&(ヌ)& 体 積 &(ル)& 金 属 &(ヲ)& 正 極 \\[ 5pt ]
&(ワ)& カソード &(カ)& 電 子 &(ヨ)& イオン化エネルギー \\[ 5pt ]
\end{eqnarray}
\]
【ワンポイント解説】
燃料電池に関する問題です。
燃料電池は今後のエネルギー戦略として,重要な役割を果たす可能性があるため,電験でも出題されることが多い分野です。
類題が出題されやすい分野でもあるので,確実に燃料電池の反応式や図は理解しておくようにしましょう。
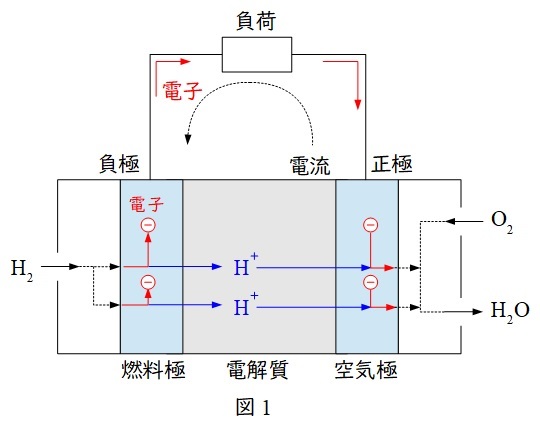
1.燃料電池の概念図
燃料電池は燃料極(負極またはアノードとも言います)に燃料として水素,空気極(正極またはカソードとも言います)に酸素を供給して,化学変化から電気エネルギーを取り出す方法で,正極と負極では以下の反応があります。
負極では水素が電子を失う酸化反応,正極では酸素が電子を受け取る還元反応が起こります。
\[
\begin{eqnarray}
負極&:&\mathrm {H_{2} → 2H^{+} +2e^{-}} \\[ 5pt ]
正極&:&\mathrm {\frac {1}{2}O_{2} + 2H^{+} +2e^{-} →H_{2}O} \\[ 5pt ]
\hline
全体&:&\mathrm {H_{2}+\frac {1}{2}O_{2} →H_{2}O}
\end{eqnarray}
\]
【解答】
(1)解答:ト
題意より解答候補は,(ト)イオン,(ル)金属,(カ)電子,になると思います。
図1の通り,電解質を通過するのは水素イオンとなります。
(2)解答:リ
題意より解答候補は,(リ)アノード,(ヲ)正 極,(ワ)カソード,になると思います。
ワンポイント解説「1.燃料電池の概念図」の通り,水素が供給されるのはアノードとなります。
(3)解答:ロ
題意より解答候補は,(ロ)低く,(ハ)変化しなく,(チ)高く,になると思います。
燃料電池の起電力は,一部の例外を除き,一般的に温度が上昇すればするほど一次関数的に低くなっていくことがわかっています。
(4)解答:ヌ
題意より解答候補は,(ヘ)酸化還元電位,(ヌ)体積,(ヨ)イオン化エネルギー,になると思います。
ファラデーの法則において,理論的な電気量は水素の物質量(モル)に比例し,理論的な気体の体積は\( \ 1 \ \mathrm {kmol} \ \)あたり\( \ 22.4 \ \mathrm {m^{3}} \ \)であることがわかっているので,電気量は体積に比例することがわかります。
(5)解答:ホ
題意より解答候補は,(イ)\( \ 2 \ \),(ニ)\( \ 1 \ \),(ホ)\( \ 4 \ \),になると思います。
ワンポイント解説「1.燃料電池の概念図」の通り,正極での反応は,
\[
\begin{eqnarray}
&&\mathrm {\frac {1}{2}O_{2} + 2H^{+} +2e^{-} →H_{2}O} \\[ 5pt ]
&⇔&\mathrm {O_{2} + 4H^{+} +4e^{-} →2H_{2}O} \\[ 5pt ]
\end{eqnarray}
\]
となるので,酸素\( \ 1 \ \)分子では\( \ 4 \ \)電子が関与することがわかります。






















 愛知県出身 愛称たけちゃん
愛知県出身 愛称たけちゃん