【問題】
【難易度】★★☆☆☆(やや易しい)
次の文章は,銅の電解精錬に関する記述である。文中の\( \ \fbox{$\hskip3em\Rule{0pt}{0.8em}{0em}$} \ \)に当てはまる最も適切なものを解答群の中から選べ。
銅鉱石を乾式精錬で純度\( \ 99 \ \)%程度にした粗銅には亜鉛,鉄,銀,金などの不純物が含まれている。粗銅を\( \ \fbox { (1) } \ \),純銅を\( \ \fbox { (2) } \ \),電解液に酸を加えた\( \ \fbox { (3) } \ \)水溶液を用いて電気分解すると\( \ \fbox { (4) } \ \)は\( \ \fbox { (1) } \ \)の下に沈殿し,その他の金属は\( \ \fbox { (5) } \ \)イオンとして溶出する。溶出した金属のうち,銅だけが\( \ \fbox { (2) } \ \)に析出して純度が\( \ 99.99 \ \)%以上になる。
この銅の電解精錬の主反応の理論電圧は\( \ \fbox { (6) } \ \mathrm {V} \ \)である。精錬できる銅の量は電解時の通電電気量に比例する。精錬可能な銅の量はファラデーの法則で推算することができる。電子の物質量当たりの電荷の絶対値をファラデー定数といい,\( \ 96485 \ \mathrm {C/mol} \ \)である。電気分解では電気量の単位を\( \ \mathrm {A\cdot h} \ \)で表すと便利であり,その値は\( \ \fbox { (7) } \ \mathrm {A\cdot h/mol} \ \)である。ファラデーの法則を用いて\( \ 1 \ \mathrm {t} \ \)の銅を精錬するために必要な電気量を求めると,\( \ \fbox { (8) } \ \mathrm {kA\cdot h} \ \)となる。なお,銅の原子量を\( \ 63.55 \ \)とする。
〔問7の解答群〕
\[
\begin{eqnarray}
&(イ)& 26.80 &(ロ)& 0 &(ハ)& 陰 \\[ 5pt ]
&(ニ)& 13.40 &(ホ)& 1687 &(ヘ)& 金や亜鉛 \\[ 5pt ]
&(ト)& 銀や鉄 &(チ)& 塩化銅 &(リ)& カソード \\[ 5pt ]
&(ヌ)& 53.60 &(ル)& 金や銀 &(ヲ)& 陽 \\[ 5pt ]
&(ワ)& 水酸化銅 &(カ)& 空気極 &(ヨ)& 中性 \\[ 5pt ]
&(タ)& アノード &(レ)& 1.2 &(ソ)& 硫酸銅 \\[ 5pt ]
&(ツ)& 421.7 &(ネ)& 843.4 && \\[ 5pt ]
\end{eqnarray}
\]
【ワンポイント解説】
粗銅から純銅を取り出す銅の電解精錬に関する問題は平成26年問4に出題されています。類題に関する出題は,かなり正答率が高くなるので確実に押さえておきたい問題となります。
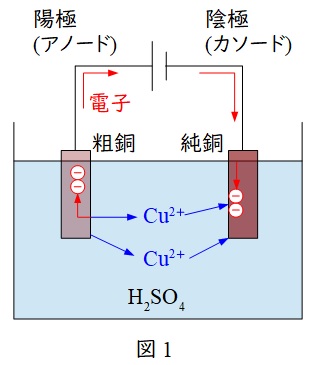
1.銅の電解精製プロセス
図1に示すようなプロセスとなり,陽極と陰極の酸化還元反応にて,陰極に銅を析出させ,銅の純度を上げることができます。
\[
\begin{eqnarray}
陽極(アノード)&:& \mathrm {Cu} &→& \mathrm {Cu}^{2+} +2\mathrm {e}^{-} \\[ 5pt ]
陰極(カソード)&:& \mathrm {Cu}^{2+} +2\mathrm {e}^{-} &→& \mathrm {Cu} \\[ 5pt ]
\end{eqnarray}
\]
2.金属のイオン化傾向
金属のイオンの成りやすさを示す指標で以下のような順番になります。高校の化学で覚え方も習ったと思います。
\[
\begin{eqnarray}
\mathrm {K}→\mathrm {Ca}→\mathrm {Na}→\mathrm {Mg}→\mathrm {Al}→\mathrm {Zn}→\mathrm {Fe}→\mathrm {Ni}→\mathrm {Sn}→\mathrm {Pb} \\[ 5pt ]
→\mathrm {( H ) }→\mathrm {Cu}→\mathrm {Hg}→\mathrm {Ag}→\mathrm {Pt}→\mathrm {Au} \\[ 5pt ]
\end{eqnarray}
\]
【覚え方】
かそうかな、まああてにするな、ひどすぎる借金
【解答】
(1)解答:タ
(2)解答:リ
題意より,解答候補は(リ)カソード,(カ)空気極,(タ)アノード,になると思います。ワンポイント解説「1.銅の電解精製プロセス」の通り,粗銅はアノード,純銅をカソードとします。
(3)解答:ソ
題意より,解答候補は(チ)塩化銅,(ワ)水酸化銅,(ソ)硫酸銅,になると思います。ワンポイント解説「1.銅の電解精製プロセス」の通り,電解液は硫酸に銅イオンが溶け込んだ硫酸銅水溶液となります。
(4)解答:ル
題意より,解答候補は(ヘ)金や亜鉛,(ト)銀や鉄,(ル)金や銀,となると思います。ワンポイント解説「2.金属のイオン化傾向」の通り,銅よりもイオン化傾向が小さい物質は沈殿し,銅よりもイオン化傾向の大きい物質は電解液に溶け出します。したがって,解答は銅よりもイオン化傾向の小さい物質の組み合わせである金と銀になります。
(5)解答:ヲ
題意より,解答候補は(ハ)陰,(ヲ)陽,(ヨ)中性,となると思います。価数は物質によって違いますが,基本的に金属は陽イオンとして溶出します。
(6)解答:ロ
題意より,解答候補は(ロ)\( \ 0 \ \),(レ)\( \ 1.2 \ \),等になると思います。銅の電解精錬はイオン化傾向を利用するものであるので,理論的には\( \ 0 \ \mathrm {V} \ \)となります。
(7)解答:イ
題意より,単位を\( \ \mathrm {C/mol} \ \)である。電気分解では電気量の単位を\( \ \mathrm {A\cdot h/mol} \ \)に変換すると,
\[
\begin{eqnarray}
96485 \ \mathrm {[C/mol]}&=& 96485 \ \mathrm {[A\cdot s/mol]} \\[ 5pt ]
&=& \frac {96485}{3600} \ \mathrm {[A\cdot h/mol]} \\[ 5pt ]
&≒& 26.80 \ \mathrm {[A\cdot h/mol]} \\[ 5pt ]
\end{eqnarray}
\]
と求められる。
(8)解答:ネ
題意より,銅の原子量が\( \ 63.55 \ \)であるから,\( \ 1 \ \mathrm {t} \ \)の銅の物質量は,
\[
\begin{eqnarray}
\frac {1000}{63.55}&≒&15.736 \ \mathrm {[kmol]} \\[ 5pt ]
\end{eqnarray}
\]
であり,ワンポイント解説「1.銅の電解精製プロセス」の通り,\( \ 1 \ \mathrm {mol} \ \)あたり\( \ 2 \ \mathrm {mol} \ \)の電子が反応するので,必要な電気量は,
\[
\begin{eqnarray}
15.736\times 2\times 26.80&≒&843.4 \ \mathrm {[kA\cdot h]} \\[ 5pt ]
\end{eqnarray}
\]
と求められる。






















 愛知県出身 愛称たけちゃん
愛知県出身 愛称たけちゃん