Contents
【問題】
【難易度】★★☆☆☆(やや易しい)
次の文章は,水の電気分解に関する記述である。文中の\( \ \fbox{$\hskip3em\Rule{0pt}{0.8em}{0em}$} \ \)に当てはまる最も適切なものを解答群の中から選べ。
電力を大量に貯蔵・輸送するために水を電気分解して水素を製造することが検討されている。水酸化カリウム水溶液などの塩基性の電解質を用いたときのカソード上の反応は,
\[
\mathrm {2H_{2}O + 2e^{-} → H_{2} + \fbox { (1) } \ OH^{-}}
\]
であり,水素の製造量は電気分解中に通電した電気量に比例する。これは電気分解に関する\( \ \fbox { (2) } \ \)の法則に従った現象である。電気素量を\( \ 1.602\times 10^{-19} \ \mathrm {C} \ \),アボガドロ定数を\( \ 6.022\times 10^{23} \ \mathrm {mol^{-1}}\)とすると,\( \ 0 \ \)℃,\( \ 1 \ \)気圧(\( \ =101.33 \ \mathrm {kPa} \ \))で\( \ 22.4 \ \mathrm {L} \ \)(\( \ =2.24\times 10^{-2} \ \mathrm {m^{3}} \ \))の水素を製造するのに必要な電気量は\( \ \fbox { (3) } \ \mathrm {C} \ \)である。アノードではカソードで生成した\( \ \mathrm {OH^{-}} \ \)を\( \ \fbox { (4) } \ \)して\( \ \fbox { (5) } \ \)を生成する。
〔問7の解答群〕
\[
\begin{eqnarray}
&(イ)& 9.65\times 10^{4} &(ロ)& フレミング &(ハ)& 酸素 \\[ 5pt ]
&(ニ)& 1.93\times 10^{5} &(ホ)& 還元 &(ヘ)& 酸化 \\[ 5pt ]
&(ト)& 1 &(チ)& 窒素 &(リ)& 2 \\[ 5pt ]
&(ヌ)& ファラデー &(ル)& 中和 &(ヲ)& ヘス \\[ 5pt ]
&(ワ)& 3.86\times 10^{5} &(カ)& 3 &(ヨ)& 過酸化水素
\end{eqnarray}
\]
【ワンポイント解説】
問題自体は三種の参考書にも載っていそうな内容ですが,出題頻度があまり高くなく二次試験にも出題されない範囲であるため,どうしても試験対策が疎かになる分野です。高校で化学を勉強された方であれば,復習に近い内容です。
1.水の電気分解
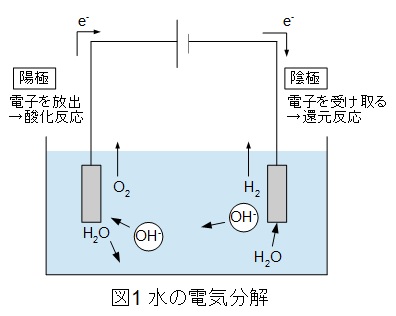
水の電気分解では陽極・陰極にて,以下の反応が起こっています。
\[
\begin{eqnarray}
&陽極(アノード): & \mathrm {2OH^{-}} &→& \mathrm {\frac {1}{2} O_{2} + H_{2}O + 2e^{-}} \\[ 5pt ]
&陰極(カソード): & \mathrm {2H_{2}O + 2e^{-}} &→& \mathrm {H_{2} + 2OH^{-}}
\end{eqnarray}
\]
2.ファラデーの法則
第一法則:電極に析出される量は電気量(電流×時間)に比例する。
第二法則:電極に析出される量は化学当量(原子量÷原子価)に比例する。
公式等もありますが,あまり丸暗記せず,第一法則と第二法則が陽極と陰極で起きている事象から計算できるようにした方がベターです。
【解答】
(1)解答:リ
ワンポイント解説「1.水の電気分解」の通り\( \ 2 \ \)となります。左辺と右辺で酸素原子\( \ \mathrm {O} \ \)と水素原子\( \ \mathrm {H} \ \)の数を合わせれば大丈夫です。
(2)解答:ヌ
ワンポイント解説「2.ファラデーの法則」の通り,電気分解はファラデーの法則に従います。ちなみに,フレミングの法則は電磁気の法則でヘスの法則は化学反応に伴う熱量に関する法則です。
(3)解答:ニ
標準状態(\( \ 0 \ \)℃,\( \ 1 \ \)気圧)の気体において,原子量に関係なく\( \ \mathrm {1 \ mol=22.4 \ L} \ \)である。したがって,本題での精製した水素は\( \ \mathrm {1 \ mol} \ \)となります。カソードの反応式より,水素\( \ \mathrm {1 \ mol} \ \)を生成するのに必要な電子は\( \ \mathrm {2 \ mol} \ \)となり,これより水素を生成するのに必要な電気量は,
\[
2 \ 〔\mathrm {mol}〕\times 6.022\times 10^{23} \ 〔\mathrm {mol^{-1}}〕\times 1.602\times 10^{-19} \ 〔\mathrm {C}〕≒1.93\times 10^{5} \ [\mathrm {C}]
\]
と求められます。
(4)解答:ヘ
ワンポイント解説図1の通り,アノードでは電子を放出するので酸化反応となります。
(5)解答:ハ
図1の通りアノードでは酸素を生成します。












 【令和8年度版2種一次試験】
【令和8年度版2種一次試験】








 愛知県出身 愛称たけちゃん
詳しくは
愛知県出身 愛称たけちゃん
詳しくは