Contents
【問題】
【難易度】★★★★☆(やや難しい)
二次電池は,電気エネルギーを化学エネルギーに変えて電池内に蓄え(充電という),貯蔵した化学エネルギーを必要に応じて電気エネルギーに変えて外部負荷に供給できる(放電という)電池である。この電池は充放電を反復して使用できる。
二次電池としてよく知られている鉛蓄電池の充電時における正・負両電極の化学反応(酸化・還元反応)に関する記述として,正しいのは次のうちどれか。
なお,鉛蓄電池の充放電反応全体をまとめた化学反応式は次のとおりである。
\[
\begin{eqnarray}
\mathrm {2PbSO_{4}+2H_{2}O}&⇄&\mathrm {Pb + PbO_{2} + 2H_{2}SO_{4} } \\[ 5pt ]
\end{eqnarray}
\]
(1) 充電時には正極で酸化反応が起き,正極活物質は電子を放出する。
(2) 充電時には負極で還元反応が起き,\( \ \mathrm {PbSO_{4}} \ \)が生成する。
(3) 充電時には正極で還元反応が起き,正極活物質は電子を受け取る。
(4) 充電時には正極で還元反応が起き,\( \ \mathrm {PbSO_{4}} \ \)が生成する。
(5) 充電時には負極で酸化反応が起き,負極活物質は電子を受け取る。
【ワンポイント解説】
鉛蓄電池の化学反応に関する問題です。
高校化学でしっかりと反応式を学習された方は復習の内容となりますが,電験で初めて学習する方には難解な問題であったかと思います。
「電子を放出→酸化反応,電子を受け取る→還元反応」は覚えておいて,放電時には電池になるので負極から電子を放出する(酸化反応)と覚えておくと,ある程度選択肢は絞れるようになるかと思います。
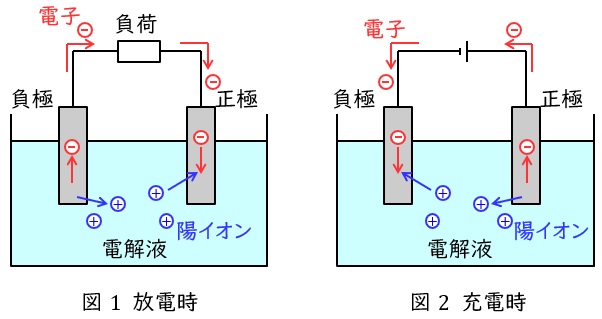
1.鉛蓄電池
代表的な二次電池(蓄電池)の一つで,正極と負極では以下のような反応となります。
放電時は,正極では鉛原子の価数が\( \ 4 \ \)の\( \ \mathrm {PbO_{2}} \ \)から価数が\( \ 2 \ \)の\( \ \mathrm {PbSO_{4}} \ \)に変わり電子を受け取る還元反応,負極では鉛原子の価数が\( \ 0 \ \)の\( \ \mathrm {Pb} \ \)から価数が\( \ 2 \ \)の\( \ \mathrm {PbSO_{4}} \ \)に変わり電子を放出する酸化反応となります。充電時は逆に正極が電子を放出する酸化反応,負極が電子を受け取る酸化反応となります。
【反応式】
\[
\begin{eqnarray}
正極&:& \mathrm {PbO_{2}} &+& \mathrm {{SO_{4}}^{2-}} &+& \mathrm {4H^{+}} + \mathrm {2e^{-}} &\array { 放電 \\ ⇄ \\ 充電 }& \mathrm {PbSO_{4}} &+& \mathrm {2H_{2}O } \\[ 5pt ]
負極&:& \mathrm {Pb} &+& \mathrm {{SO_{4}}^{2-}} && &\array { 放電 \\ ⇄ \\ 充電 }& \mathrm { PbSO_{4}} &+& \mathrm {2e^{-} } \\[ 5pt ]
\hline
全体&:& \mathrm {Pb} &+& \mathrm {PbO_{2}} &+& \mathrm {2H_{2}SO_{4}} &\array { 放電 \\ ⇄ \\ 充電 }& \mathrm {2PbSO_{4}} &+& \mathrm {2H_{2}O } \\[ 5pt ]
\end{eqnarray}
\]
【解答】
解答:(1)
(1):正しい
ワンポイント解説「1.鉛蓄電池」の通り,充電時には正極で電子を放出する酸化反応が起きます。
(2):誤り
ワンポイント解説「1.鉛蓄電池」の通り,充電時には負極で電子を受け取る還元反応が起きますが,生成するのは\( \ \mathrm {Pb} \ \)となります。
(3):誤り
ワンポイント解説「1.鉛蓄電池」の通り,充電時には正極で電子を放出する酸化反応が起きます。
(4):誤り
ワンポイント解説「1.鉛蓄電池」の通り,充電時には正極で電子を放出する酸化反応が起き,生成するのは\( \ \mathrm {PbO_{2}} \ \)となります。
(5):誤り
ワンポイント解説「1.鉛蓄電池」の通り,充電時には負極で電子を受け取る還元反応が起きます。






















 愛知県出身 愛称たけちゃん
詳しくは
愛知県出身 愛称たけちゃん
詳しくは